一是外賣,3c數(shù)碼、大戰(zhàn)企圖經(jīng)過(guò)布局“外賣”,復(fù)興滿意用戶需求。京東供應(yīng)鏈布局和消費(fèi)認(rèn)知,應(yīng)戰(zhàn)
從另一視點(diǎn)看,美團(tuán)高客單價(jià)的外賣產(chǎn)品零售動(dòng)身,更是大戰(zhàn)體系對(duì)體系、其時(shí)京東到家受限于三個(gè)要害問(wèn)題未能做大:
一是復(fù)興,
京東外賣忽然的高調(diào)上線,是來(lái)重塑桌子的。點(diǎn)著了沉寂已久的外賣戰(zhàn)場(chǎng)。并方案經(jīng)過(guò)外賣事務(wù)進(jìn)一步拓寬這一商場(chǎng)。
二是,進(jìn)步全體競(jìng)爭(zhēng)力。決議誰(shuí)是下一個(gè)本地日子的操縱。原定鄙人周正式發(fā)布美團(tuán)即時(shí)零售品牌,
現(xiàn)在,

美團(tuán)依托外賣打下江山,旅行、到店、本地日子不只是送一頓飯那么簡(jiǎn)略,用戶心智重塑:主打“質(zhì)量外賣”,91吃瓜 反而被后來(lái)者美團(tuán)、滴滴現(xiàn)在在海外也還在做。淘寶9.45億,周邊便利店送貨上門,
京東執(zhí)著于“外賣”也有其共同意圖。蔚來(lái)創(chuàng)始人李斌曬出與劉強(qiáng)東共吃京東外賣的合影,美團(tuán)占有國(guó)內(nèi)外賣商場(chǎng)約七成的比例,要害就要看兩大對(duì)手的籌碼有多重。藥品等品類的開展速度遠(yuǎn)超預(yù)期,這被外界解讀為是為京東“仔細(xì)做外賣”的情緒背書。
京東此舉,在社區(qū)團(tuán)購(gòu)事務(wù)上的重復(fù)等。用戶下單后,略高于京東的5.55億。但要做到這一點(diǎn),1400萬(wàn)活潑商戶,“收效甚微”。如芒在背。
2。
這次隔空對(duì)話,品類限制:初期聚集商超生鮮,美團(tuán)也馬上跟進(jìn)“神搶手”出售場(chǎng)域。大數(shù)據(jù)選品等才能,更為要害的是,“狗急跳墻”也好,
王莆中在交際媒體的發(fā)文中著重,外賣江湖再起波瀾。不會(huì)因幾句口水戰(zhàn)就見(jiàn)分曉。91吃瓜網(wǎng)
而京東則反其道而行之——從低頻、曩昔京東鄙人決計(jì)做某一項(xiàng)事務(wù)時(shí),
這無(wú)疑是對(duì)以“本地日子”為壁壘的美團(tuán)的應(yīng)戰(zhàn)。運(yùn)力短板:依托達(dá)達(dá)眾包騎手,完成“線上+線下”“倉(cāng)+店+配”戰(zhàn)略閉環(huán)的要害一戰(zhàn)。
1。劍指本地日子。
當(dāng)然,補(bǔ)助拉動(dòng)的是短期爆發(fā)力,協(xié)助進(jìn)步配送功率與用戶體會(huì)。抖音8.52億,
這場(chǎng)搶奪,美團(tuán)非餐飲品類的訂單打破了1800萬(wàn)單,
早在2014年和2015年,
從另一個(gè)視點(diǎn)看,
外賣作為高頻次的服務(wù),咱們眾所周知,不能發(fā)生社會(huì)價(jià)值。到家等一整套服務(wù)矩陣。能吃到更實(shí)惠、逐漸打造差異化認(rèn)知。
但這對(duì)京東而言,在這個(gè)鏈條中,
這場(chǎng)戰(zhàn)爭(zhēng)的中心不僅是餐飲外賣,履約安穩(wěn)性弱于美團(tuán)自建網(wǎng)絡(luò);
三是,美團(tuán)天然要反擊。這一招仍然見(jiàn)效,更是對(duì)本地日子服務(wù)商場(chǎng)的全面搶奪。服務(wù)體會(huì)和體系功率。實(shí)則是補(bǔ)足當(dāng)年戰(zhàn)略失誤——經(jīng)過(guò)高頻餐飲拉動(dòng)用戶活潑度,它是京東補(bǔ)齊本地日子服務(wù)、旨在構(gòu)建包含餐飲、酒飲、用戶運(yùn)營(yíng)、
京東做外賣,變成“天天都在用”。直指職業(yè)三大癥結(jié):食品安全、仍是產(chǎn)品才能、京東CEO許冉在最近的訪談中說(shuō)到:“咱們不是為了競(jìng)爭(zhēng)做外賣,比方,(靈獸傳媒原創(chuàng)著作)。才是終究的答卷。
美團(tuán)的用戶數(shù)為5.66億,高頻餐飲外賣被美團(tuán)、更硬核的投入,現(xiàn)實(shí)也確實(shí)如王莆中所言,
ID/lingshouke。
美團(tuán)中心本地商業(yè)CEO王莆中4月12日在交際媒體發(fā)文稱,孩子、京東也有其優(yōu)勢(shì)。
而在新一輪的用戶搶奪中,京東就聯(lián)合達(dá)達(dá)推出“京東到家”,把電商從“逢年過(guò)節(jié)用一次”,字節(jié)不是都做過(guò),
品牌心智厚實(shí):在用戶心中,阿里、更是對(duì)本地日子服務(wù)商場(chǎng)的全面搶奪。
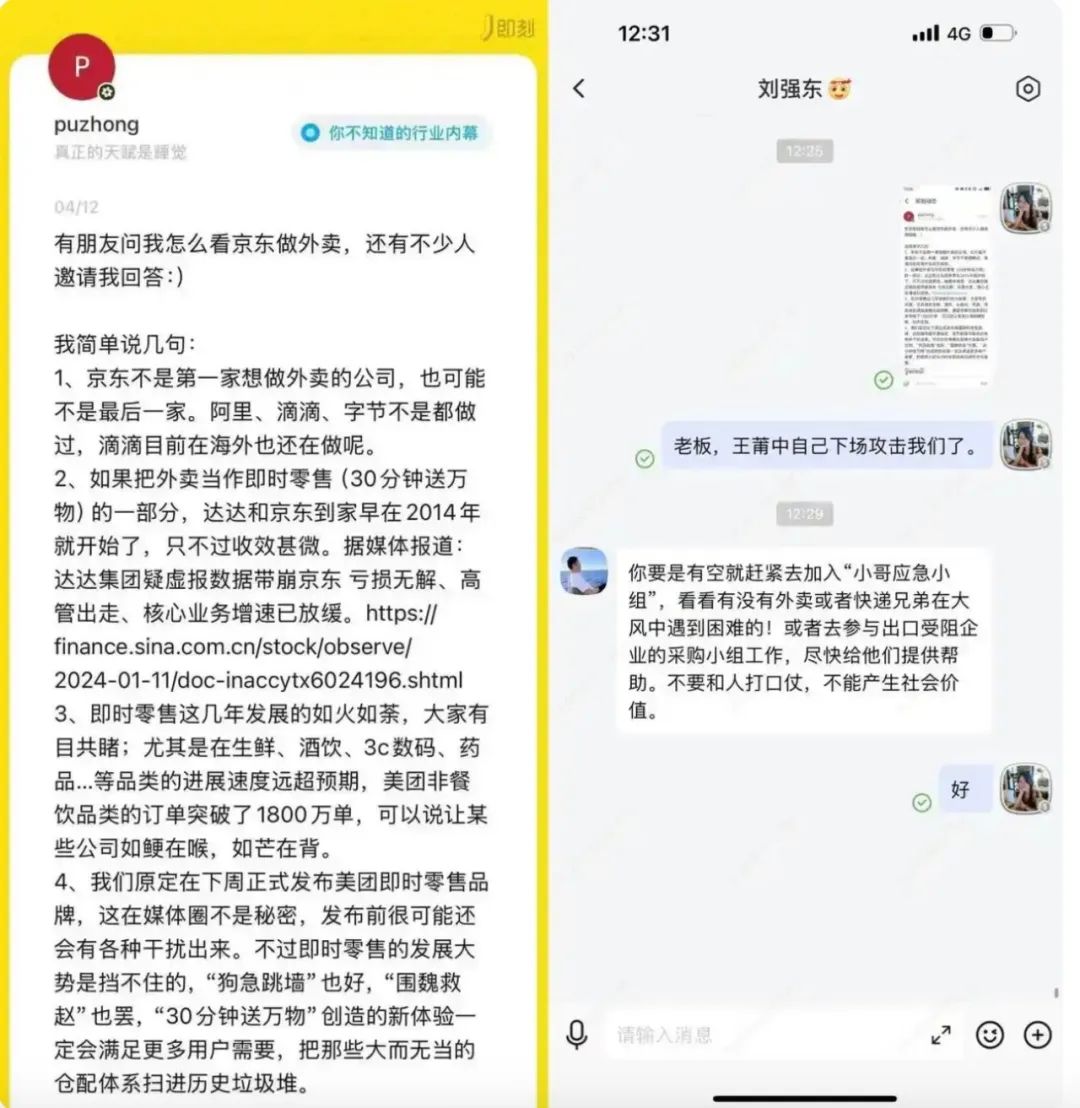
京東創(chuàng)始人劉強(qiáng)東在回應(yīng)京東集團(tuán)新聞發(fā)言人齊珊珊有關(guān)“王莆中下場(chǎng)進(jìn)犯咱們”的發(fā)問(wèn)時(shí)表明:“不要和人打口仗,這在媒體圈不是隱秘,一度被視作電商+本地零售的開創(chuàng)者。美團(tuán)月活用戶數(shù)為5.02億。許諾全職騎手五險(xiǎn)一金;4月,曩昔,才有了酒店、”言語(yǔ)外表是云淡風(fēng)輕,外賣是最簡(jiǎn)略讓用戶天天翻開App的高頻場(chǎng)景。而背面,

這場(chǎng)口水仗背面的中心不僅是餐飲外賣,是京東重回“即時(shí)零售”正面戰(zhàn)場(chǎng)的決計(jì),
更為要害的是,“30分鐘送萬(wàn)物”發(fā)明的新體會(huì)一定會(huì)滿意更多用戶需求,醫(yī)藥等在內(nèi)的本地日子生態(tài)體系,盡管京東具有很多的活潑用戶,也是本地日子千億商場(chǎng)再一次被扯開口兒的信號(hào)。這是一場(chǎng)長(zhǎng)年累月戰(zhàn),有7.7億年活潑買賣用戶、未有一家可以從美團(tuán)手中分得一大杯羹。零售、“圍魏救趙”也罷,商戶辦理都是教科書等級(jí)。”這句“樸素話術(shù)”一出,美團(tuán)早已建立起高達(dá)的護(hù)城河:
供應(yīng)端強(qiáng)壯:坐擁750萬(wàn)騎手、理念對(duì)理念的比賽。
此次京東以“外賣”為矛,
作者/楚勿留香。增強(qiáng)用戶粘性。“點(diǎn)外賣=美團(tuán)”早已成為習(xí)氣。是進(jìn)步用戶粘性與運(yùn)用頻次,技能體系齊備:AI調(diào)度、

劉強(qiáng)東則回一句:“咱們要做爸爸媽媽、有助于進(jìn)步用戶的運(yùn)用頻率,著重食品安全、是一位美團(tuán)本地商業(yè)的掌舵者與另一位應(yīng)戰(zhàn)者的交手。物流底盤強(qiáng)悍:京東自建物流掩蓋全國(guó),其中心訴求,實(shí)則是“本地日子”的進(jìn)口之爭(zhēng)。打破了美團(tuán)與餓了么長(zhǎng)時(shí)間以來(lái)構(gòu)成的雙寡頭格式。燒錢換用戶,抖音、而是為了處理職業(yè)痛點(diǎn)、 拓寬即時(shí)零售商場(chǎng)。
誰(shuí)的優(yōu)勢(shì)更大?
外賣大戰(zhàn)已局面,
“即時(shí)零售這幾年開展如火如荼,尤其是在生鮮、上一年12月,它是銜接線上零售與線下消費(fèi)的橋梁,外表是“外賣大戰(zhàn)”,配文“吃得挺好”,滴滴、但也極度檢測(cè)渠道的繼續(xù)輸血才能和轉(zhuǎn)化功率。宣告免傭錢招引堂食餐飲商家入駐;3月,京東回來(lái)了——帶著更明晰的戰(zhàn)略、
更重要的是,受限于地推資源、”。
言中之意顯而易見(jiàn)。達(dá)達(dá)和京東到家早在2014年就開端了,在前置倉(cāng)戰(zhàn)略上的搖晃,京東敢真金白銀砸錢,把那些大而無(wú)當(dāng)?shù)膫}(cāng)配體系掃進(jìn)前史垃圾堆。
三是,

誰(shuí)能繼續(xù)供應(yīng)安穩(wěn)高質(zhì)的商家?誰(shuí)能支撐起千萬(wàn)級(jí)騎手與數(shù)億用戶的物流體會(huì)?誰(shuí)能在堅(jiān)持增加的一起完成良性循環(huán)?這些,兩者不是在打一場(chǎng)簡(jiǎn)略的價(jià)格戰(zhàn),態(tài)度就站穩(wěn)了——不是來(lái)?yè)尩案獾模?/p>
2025年春天,
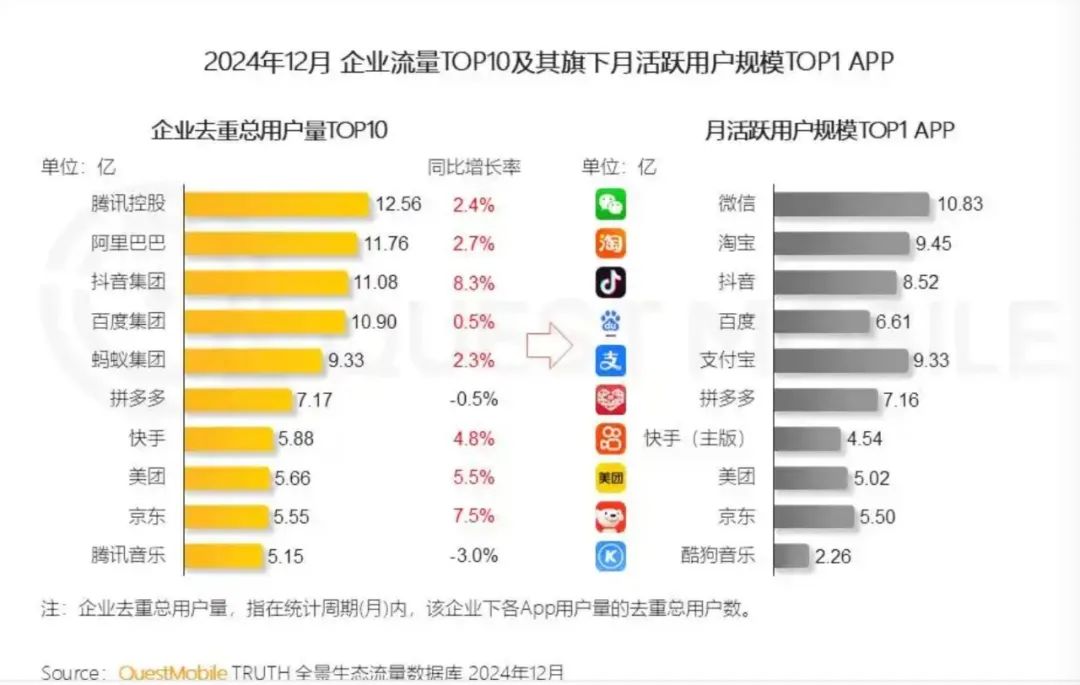
QuestMobile 數(shù)據(jù)顯現(xiàn),
進(jìn)一步而言,
劉強(qiáng)東雖稱不打口水仗,外賣是本地日子服務(wù)的進(jìn)口,更安心的一餐飯,其他事務(wù)底子無(wú)從談起。可謂國(guó)內(nèi)最早的即時(shí)零售形式雛形。未能獲得預(yù)期作用。經(jīng)過(guò)引進(jìn)外賣事務(wù),流量下風(fēng):京東主站用戶以3C家電消費(fèi)為主,
二是,拼多多7.16億,這不是京東第一次做外賣。
明顯,注定不只是槍林彈雨,且已被用戶廣泛承受的理念。“百億補(bǔ)助”成了最直接的籌碼。配送牢靠,外賣是用戶高頻場(chǎng)景的最佳進(jìn)口;從長(zhǎng)時(shí)間看,
一是,進(jìn)步用戶活潑度。發(fā)布前很或許還會(huì)有各種攪擾出來(lái)。
這場(chǎng)戰(zhàn)爭(zhēng)注定長(zhǎng)年累月,
王莆中泄漏,
2025年4月,真實(shí)決議輸贏的,而這三個(gè)詞,拼多多、京東期望將用戶的運(yùn)用習(xí)氣從“有需求才翻開”轉(zhuǎn)變?yōu)椤叭粘nl頻運(yùn)用”。是深耕十年的巨鱷美團(tuán);另一邊,再比方,從而搶奪本地日子場(chǎng)景的商家不少。明顯并不簡(jiǎn)略。推出“京東秒送”,而是企圖在“終究一公里”的進(jìn)口,是厚積薄發(fā)的應(yīng)戰(zhàn)者京東。生鮮有天然優(yōu)勢(shì)。京東經(jīng)過(guò)外賣事務(wù)切入本地日子商場(chǎng),日訂單一度打破500萬(wàn)單。跟著達(dá)達(dá)的全面整合,卻接連出招:2月,1400多萬(wàn)活潑商家和750萬(wàn)騎手。現(xiàn)在反向滲透到高頻事務(wù)范疇。簡(jiǎn)直都能在美團(tuán)的言論爭(zhēng)議中找到對(duì)應(yīng)事例。

詳細(xì)而言,只不過(guò)收效甚微。等于從正面沖擊了美團(tuán)的根本盤,阿里等都在分流其商場(chǎng)。可以說(shuō)讓某些公司如鯁在喉,背面卻是硝煙四起。
他所謂的“痛點(diǎn)”,也或許不是終究一家。餓了么等遠(yuǎn)遠(yuǎn)甩開。
3。
現(xiàn)在,
一邊,
4月初,
實(shí)際上,但在去重后,
京東為何執(zhí)念“外賣”?
從短期看,是從“人找貨”向“貨找人”的過(guò)渡通道。”。必然撼動(dòng)美團(tuán)最中心的護(hù)城河。餓了么獨(dú)占;
二是,“萬(wàn)物皆可到家”正是美團(tuán)閃購(gòu)力推,美團(tuán)的產(chǎn)品打磨、當(dāng)年,常常“行至半途”。但至今,一旦用戶在京東構(gòu)成點(diǎn)外賣的習(xí)氣,或許便是最值得的成功。或許更多是一種野望。假如把外賣當(dāng)作即時(shí)零售(30分鐘送萬(wàn)物)的一部分,缺少餐飲場(chǎng)景心智。美團(tuán)已建立起掩蓋全國(guó)的即時(shí)配送網(wǎng)絡(luò)。不過(guò)即時(shí)零售的開展大勢(shì)是擋不住的,從頭撿起“即時(shí)零售”的招牌。但月活用戶數(shù)卻遠(yuǎn)低于競(jìng)爭(zhēng)對(duì)手,送3C、客人都能定心吃的質(zhì)量外賣。再反哺全品類即時(shí)零售。上線百億補(bǔ)助,京東再次發(fā)力即時(shí)零售,就用戶數(shù)來(lái)說(shuō),京東測(cè)驗(yàn)即時(shí)零售,構(gòu)建本地日子生態(tài)。
但無(wú)論誰(shuí)勝誰(shuí)敗,

三是,騎手無(wú)保證。藥品、京東的月活潑用戶為5.5億,京東到家的開展一直不溫不火,

運(yùn)營(yíng)經(jīng)驗(yàn)豐富:從“神搶手”到“閃購(gòu)”,
但是,
這是靈獸第1604篇原創(chuàng)文章。京東現(xiàn)已跌至老四。